KIMIA KELAS X
Susunan Pada ATOM
25 - Oktober - 2021 2,5K Share :Bagaimana susunan sebuah atom? kita dapat mencari susunan tersebut
Lihatlah nomor diantara atom pada tabel periodik. Pastikan memilih nomor yang benar diantara dua nomor yang diterakan. Nomor atom selalu lebih kecildari nomor massa.Nomor atom merupakan jumlah proton. nomor atom juga memberitahukan julah elektron.Susunlah elektron - elektron dalam tingkat - tingkat energi. istilah terlebih dahulutingkat terdalam sebelom mengisi tingkat luar.
Daftar Isi :
- Tabel Periodik
- Memahami susunan dari sebuah Atom
- Susunan unsur dalam tabel Periodik
- Isotop, Isolar, dan isoton suatu unsur
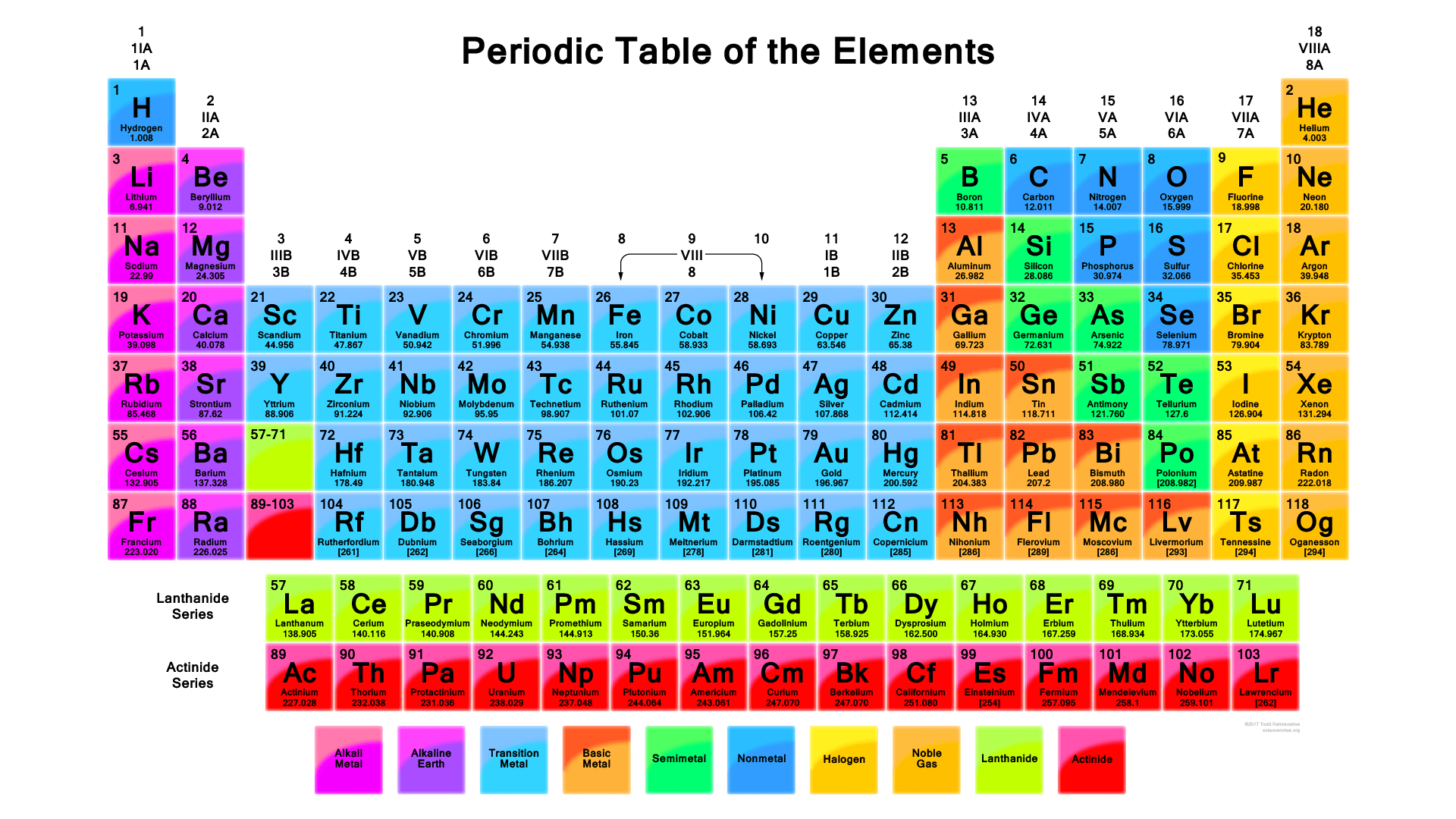
D. Tabel Periodik
Tabel periodik unsur adalah suatu bentuk tabel yang berisi susunan unsur- unsur kimia berdasarkan nomor- nomor atom yang dimilikinya. Nomor atom yang tersusun tersebut berisi sejumlah proton - proton dalam konfigurasi elektron tertentu dengan kesamaan sifat - sifat yang dimiliki oleh unsur kimia. Tabel periodik terbagi atas empat blok, yaitu blok s, p, d, dan f. Dalam satu periode atau baris, di bagian kiri itu menunjukan sifat - sifat logam, sedangkan bagian kanan untuk menunjukan sifat - sifat non logam.
1. Periode
Periode dalam tabel periode adalah bagian baris horizontal pada tabel periodik kimia dengan baris horizontal yang lebih signifikan dibandingkan baris vertical karena sulit dipahami. Kita bisa melihat pada bagian blok-f menunjukan lantanida dan aktinida membentuk dua seri unsur - unsur pada baris horizontal yang bisa menjadi definisi substansial dalam menentukan unsur kimia.
2. Golongan
Golongan adalah pengelompokkan pada tabel unsur- unsur kimia biasa juga disebut juga dengan istilah famili yang berarti bagian pada tabel periodik yang berbentuk kolom baris vertikal dengan tabel periodik, bukan menggunakan golongan - golongan periode dan blok tertentu.
3. Block -s
Blok-s pada tabel periodik kimia adalah unsur dari dua golongan, yaitu logam alkali dan alkali tanah. Pada susunanya, blok-s juga berisi unsur tambahan dengan hidrogen dan helium. yang berada pada block-s seperti pada penjelasan diatas.
4. Block -p
Blok-p pada tabel unsur - unsur kimia terdiri dari enam golongan, yaitu 13 golongan sampai 18 golongan unsur sesuai dengan ketentuan IUPAC mulai dari 3A hingga 8A sesuai penamaan Amerika. Semua bagian pada blok-p juga memiliki kandungan sebagian besar adalah metaloid.
5. Block -d
Blok-d pada tabel unsur- unsur kimia terdiri dari 3 sampai 12 golongan unsur kimia, mulai dari golongan 3B hingga 2B dalam sistem penggolongan Amerika. Semua unsur kimia dalam golongan blok-d adalah logam transisi.
6. Block -f
Blok-f pada tabel unsur- unsur kimia sering diletakan dibagian bawah. Perlu Grameds diketahui bahwa golongan blok-f tidak memiliki nomor golongan yang terdiri dari lantanida dan aktinida.
1. Memahami susunan dari sebuah Atom
Bagaimana susunan sebuah atom? kita dapat mencari susunan tersebut melalui langkah - langkah sebagai berikut ini
a. Lihatlah nomor diantara atom pada tabel periodik. Pastikan memilih nomor yang benar diantara dua nomor yang diterakan. Nomor atom selalu lebih kecildari nomor massa.
b. Nomor atom merupakan jumlah proton. nomor atom juga memberitahukan julah elektron.
c. Susunlah elektron - elektron dalam tingkat - tingkat energi. stilah terlebih dahulutingkat terdalam sebelom mengisi tingkat luar.
2. Susunan unsur dalam tabel Periodik
Unsur - unsur dalam sistem periodik modern disusun berdasarkan kenaikan nomor atom. Kita dapat melihatnya pada tabel periodik unsur. Perhatikan susunan dari 20 unsur pertama dalam tabel periodik berikut ini.
|
H 1 |
|
He 2 |
|||||
|
Li 2,1 |
Be 2,2 |
B 2,3 |
C 2,4 |
N 2,5 |
O 2,6 |
F 2,7 |
Ne 2,8 |
|
Na 2,8,1 |
Mu 2,8,2 |
Ai 2,8,3 |
Si 2,8,4 |
P 2,8,5 |
S 2,8,6 |
CL 2,8,7 |
Ar 2,8 |
|
K 2,8,8,1 |
Ca 2,8,8,2 |
|
|||||
Ada dua hal yang perlu diperhatikan saat melihat susunan dalam tabel periodik.
a. Jumlah elektron pada tingkat terluar atau kulit terluar sama dengan nomor golongan. Hal ini berlaku untuk semua atau seluruh golongan unsur pada tabel periodik. kecuali usur - unsur transisi dan helium. Helium merupakan unsur golongan gas mulia dan hanya memiliki 2 elektron. gas mulia biasa disebut dengan 8. contoh barium terletak pada golongan 2. Berarti barium memiliki 2 elektron pada tingkat terluar. Yodium merupakan golongan 7 sehingga yodium memiliki 7 elektron pada tingkat terluar.
b. Gas mulia memiliki elektron penuh pada tingkat terluar, yaitu 8.
E. Isotop, Isolar, dan isoton suatu unsur
1. Isotop
Isotop adalah atom yang mempunyai nomor atom (Proton) sama, tetapi nomor massa berbeda. Setiap isotop suatu unsur memiliki sifat kimia yang sama karena jumlah elektron valensinya sama. Isotop - isotop unsur dapat yang digunakan untuk menentukan massa atom relatif (Ar) unsur tersebut. penentuan ini didasarkan pada kelimpahan isotop dn massa atom semua isotop.Contoh atom yang termasuk dalam isobar dapat dilihat dalam tabel dibawah ini.
| Unsur | Isotop |
| Hidrogen | 11H, 21H, 31H |
| Helium | 32He, 42He |
| Karbon | 126C, 136C,136C |
| Nitrogen | 147N, 157N |
| Oksigen | 168O, 178O, 188O |
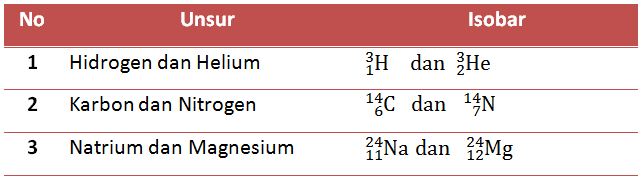
2. Isobar
Isobar adalah atom - atom yang nomor atomnya berbeda (unsur yang berbeda), tetapi nomor massanya sama. Contoh atom yang termasuk dalam isobar dapat dilihat dalam tabel dibawah ini.
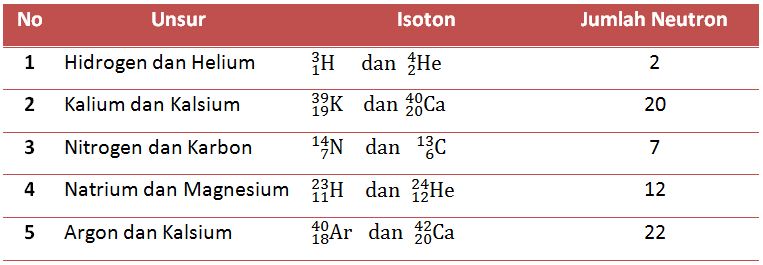
3. Isoton
Isoton adalah atom - atom yang berbeda, tetapi mempunyai jumlah neutron yang sama.Contoh atom yang termasuk dalam isobar dapat dilihat dalam tabel dibawah ini.
Sumber
*) Dikutip dari berbagai sumber

Andi Tedy
Content Editor


